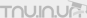Изменения окислительно-восстановительного потенциала среды
Изменения окислительно-восстановительного потенциала среды культивирования устойчивой к тяжелым металлам бактерии Pseudomonas diminuta: взаимосвязь с выделением из клеток металлотионеинподобных белковОсобое положение тяжелых металлов (ТМ) среди загрязнителей связано как с возможностью их накопления организмами и передачи по пищевым цепям, так и с высокой токсичностью (Reddy, Prasad, 1990). Воздействие ТМ прежде всего сказывается на первичных продуцентах - микроводорослях и цианобактериях, которые наравне с гетеротрофными микроорганизмами могут использоваться для детоксикации и извлечения ценных металлов, поскольку способны аккумулировать их из водной среды и донных отложений в количестве, многократно превышающем потребность в них, как в компонентах минерального питания (Nagase et al., 1994). Наибольшей устойчивостью к ТМ отличаются микроорганизмы, выделенные в местах, содержащих промышленные загрязнения, либо месторождения соответствующего металла (Горленко и др., 1977).Ванадий, как один из широко распространенных ТМ, используется зелеными, желто-зелеными и бурыми водорослями, содержится в альтернативных нитрогеназах некоторых почвенных бактерий, но не является необходимым элементом для развития большинства прокариотных микроорганизмов, среди которых наиболее активными биоаккумуляторами ванадия являются бактерии рода Pseudomonas, а также ряд цианобактерий (Rehder, 1991). Его токсический эффект обусловлен главным образом тем, что восстанавливаясь в клетках, он стимулирует образование свободнорадикальных состояний О2 (Popper et al., 1991).Ионы ТМ образуют меркаптиды с SH-группами тиоловых соединений клеток: реакция обратима, но равновесие ее смещено в сторону слабодиссоциирующих металлтиолатов (Торчинский, 1977). Устойчивость фототрофных и других микроорганизмов к действию ТМ в наибольшей степени обусловлена специфическим связыванием основной части поглощенных клетками ТМ смежными остатками цистеина в молекуле специализированных белков - металлотионеинов (МТ). Общим для этих белков является молекулярная масса до 10 кДа и высокое содержание тиоловых групп. В спектре оптического поглощения МТ в УФ-области около 250 нм, наблюдаются типичные для металлтиолатных комплексов шиpокие полосы, которые исчезают пpи удалении металла (Ang, Wong, 1992). Цианобактерии, культивируемые в присутствии высоких концентраций ванадата синтезируют связывающий ионы металла МТ второго класса (Саванина и др., 1995).В настоящей работе установлена корреляция между зависимым от ванадата накоплением в среде культивирования бактерий Ps. diminuta низкомолекулярных, богатых SH-группами белков и изменениями окислительно-восстановительного потенциала (Eh) среды.Материалы и методыВ работе использовали гетеротрофные бактерии, выделенные из придонного осадка ванадийсодержащего промышленного водоема и идентифицированные нами как Ps. diminuta (Саванина и др., 1998). Бактерии культивировали при температуре 25-27° в конических колбах на среде, содержащей в 100 мл водопроводной воды глюкозу и пептон в концентрации по 1 г/л (pH 7,2).Для определения в культуральной жидкости Ps. diminuta содержания низкомолекулярных белков и SH-групп пробы диализовали 24 час при 0о против 50 мМ Трис-HCl буфера, pH 7,6, включающего 10 мМ ЭДТА с использованием мембраны фирмы Serva (Германия) с диаметром пор, пропускающих молекулы массой <10-15 кД. В присутствии ЭДТА, сульфгидрильные группы МТ и других SH-содержащих соединений освобождаются от большей части связанного ванадия и становятся реакционноспособными.Плотность клеточных суспензий определяли нефелометрически при 540 нм на спектрофотометре фирмы Hitachi (Япония), модель U-2000. Для определения концентрации ванадия в биологическом материале и культуральной жидкости использовали цветную реакцию ванадия с 4-(2-пиридилазо)-резорцином. Клетки предварительно трижды отмывали от среды культивирования и озоляли азотной кислотой. Оптическую плотность измеряли на том же спектрофотометре при 520 нм используя коэффициент молярной экстинкции 24500 М-1см-1. Содержание диализованных низкомолекулярных белков определяли по Лоури (Lowry et al., 1951). Концентрацию тиоловых групп в этих белках и других соединениях определяли с реактивом Элмана (5,5'-дитиобис(2-нитробензойная) кислота) в присутствии ЭДТА (Веревкина и др., 1977) и регистрировали при длине волны 412 нм на том же спектрофотометре используя коэффициент молярной экстикции 11400 М-1см-1. Величины pH и Eh среды култивирования измеряли на электрометре фирмы Cole-Parmer (США), модель DigipHase, pH определяли с помощью комбинированного стеклянного электрода с двойным Ag/AgCl электродом сравнения фирмы Radiometer (Голландия); для определения Eh использовали Pt-электрод, а в качестве электрода сравнения - Ag/AgCl (оба электрода Российского производства); потенциал электрода сравнения относительно нормального водородного электрода, измеренный как в работе (Barsky, Samuilov, 1979), составляет 225±10 мВ. Таким образом, истинная величина Eh среды представляет собой сумму измеряемой величины Eh и потенциала электрода сравнения.Рис. 1. Эффект ванадата на рост культуры Ps. diminuta; 1 - контроль; 2, 3 - в присутствии 100 и 700 мг/л ванадата соответственно.Результаты и их обсуждениеКлетки Ps. diminuta, изолированные из пробы придонного осадка промышленного водоема, сбросовые воды которого содержат как отходы металлургического производства ванадий в концентрации 100-700 мг/л, хорошо растут как без ванадата, так и в его присутствии; при этом максимальное количество клеток бактерий достигает 2x107 кл/мл среды через 12-16 суток культивирования (рис. 1). Ванадат в концентрации 700 мг/л снижает накопление биомассы Ps. diminuta на 30-40%. В дальнейших опытах ванадат добавляли в концентрации 100 мг/л, поскольку не оказывая заметного влияния на рост бактерий, ванадат в этой концентрации значительно стимулировал выделение из клеток низкомолекулярных белков.Применение метода диализного (смешанно-раздельного) культивирования фототрофных микроорганизмов - цианобактерий или микроводорослей с гетеротрофными бактериями рода Pseudomonas (Гусев и др., 1988) позволило выявить ряд закономерностей роста двух различных культур, разделенных полупроницаемой мембраной. При культивировании фототрофного компонента в присутствии ванадата клетки активно выделяют в среду углеводы и гликолат. Эти соединения используются для роста гетеротрофным компонентом в качестве субстратов окисления. При этом бактерии эффективно поглощают ванадат, существенно снижая его концентрацию в среде (Саванина и др., 1994; Гусев и др., 1997).Рис. 2. Содержание ванадата в клетках (1) и в среде (2) в зависимости от возраста культуры Ps. diminuta.Действительно, как показывают наши опыты содержание ванадата в клетках Ps. diminuta, в течение первых 2 суток культивирования быстро увеличивается от 0 до 5-6 мкг/млн клеток, а затем снижается приблизительно в 10 раз (рис. 2, кривая 1). Иная картина наблюдается относительно концентрации ванадата в культуральной жидкости. За первые двое суток культивирования Ps. diminuta содержание ванадата в среде падает от 100 до 10-12 мг/л, а затем начинает постепенно увеличиваться по мере развития культуры; причем в среду возвращается до 60% ванадата (рис. 2, кривая 2). Как видно, накопление ионов ванадия в клетках коррелирует c его содержанием в культуральной жидкости: увеличение концентрации ванадата в клетках сопровождается ее снижением в среде культивирования и наоборот.Столь значительное увеличение концентрации ванадата в среде по мере выхода кривой роста на стационарный уровень может быть обусловлено тем, что ванадат выделяется из нативных и разрушенных клеток вместе с компонентами связывающими металл. Такими компонентами прежде всего являются низкомолекулярные богатые S...